

Reconnaisance coloniale "Nestmate recognition" et Gestalt
Alain Lenoir Mis à jour 23-Fév-2026
L'identité coloniale chez les insectes sociaux est basée sur la reconnaissance coloniale. Le plus souvent les colonies sont fermées aux étrangers, parfois de manière très stricte (exemples les oecophylles, Manica rubida, Camponotus cruentatus), parfois moins. Miss Fielde suggérait déjà dans les années 1900 le rôle de substances chimiques dans la reconnaissance coloniale (Fielde 1901, 1903). En 1975 P. Howse proposait que les insectes sociaux se reconnaissent avec des substances cuticulaires non volatiles. Howard (1993) avait vu que les lipides cuticulaires sont spécifiques de l'espèce et de la colonie. Parmi ces lipides il y a les hydrocarbures et tous les travaux ont montré que la fermeture coloniale est liée à une odeur collective que l'on peut assimiler à un code-barre (Passera). Crozier et Dix (1979) ont émis l'hypothèse que les profils cuticulaires se mélangent entre ouvrières formant une odeur coloniale "Gestalt odour" caractéristique de la colonie -voir plus loin).
Voir Les
Fourmis de Stéphanie Ledu 


À partir de 1980 j’ai entrepris l’étude d’une nouvelle espèce, Cataglyphis cursor, pour aborder les problèmes de la reconnaissance coloniale. Le premier niveau de reconnaissance chez les insectes sociaux est en effet la société : il est bien connu que les colonies sont fermées aux individus des autres colonies (et bien sûr d’autres espèces) qui sont rejetés et même tués. Mon attention avait été attirée sur la fourmi Cataglyphis cursor par des articles de Henri Cagniant de Toulouse ; cet auteur a en effet décrit chez cette espèce une reproduction par parthénogenèse thélytoque (production de femelles) en l’absence de reine. Il pouvait être intéressant de tester la reconnaissance interindividuelle entre fourmis de divers degrés de parenté. En fait le modèle s’est révélé très intéressant pour d’autres raisons, après les premières observations sur le terrain et au laboratoire : les sociétés ne sont que partiellement fermées dans un même habitat car elles se reproduisent par bouturage. C’est donc une situation intermédiaire entre les espèces à sociétés très fermées (la plupart des espèces) et les espèces à groupes ouverts formant dans la situation extrême une unique super-société. Par ailleurs je me suis intéressé à la reconnaissance coloniale dans les soins au couvain (premiers travaux sur Lasius niger, Lenoir 1981) et Cataglyphis cursor pouvait être aussi un bon modèle. J’ai ainsi montré que dans une colonie les larves hétérocoloniales sont moins nourries, argument important pour la sélection de parentèle (Lenoir 1984).
La reconnaissance coloniale a été bien démontrée chez d'autres insectes sociaux comme les guêpes Polistes (voir Passera Les insectes Rois de l'adaptation (p.75), d'après Bonavita-Cougourdn et al 1991). Les isopodes terrestres Hemilepistus reaumurii des régions arides d’Afrique du Nord ont une vie sub-sociale formant des familles qui ont différents profils d'hydrocarbures comme les colonies de fourmis, pourtant les fèces ne sont pas typiques de la famille (Ayari et al. 2016). Chez Armadillidium les bactéries symbiotiques Wolbachia ont un rôle dans la mise en place de l’odeur cuticulaire qui permet le choix d’orientation sexuelle, les mâles savent différencier des femelles infectées ou non (Richard 2017).
Les
sociétés d'insectes, Tdc (Textes et documents pour la classe,
par le CNDP Centre National de Documentation Pédagogique), n°606,
22 janvier 1992, par Anne Teyssèdre.. Pdf
complet
Voir Le visa chimique chez les fourmis, par Anne Teyssèdre (p.23). Voir
Apprentissage
préimaginal
La reconnaissance coloniale s'apprend par apprentissage préimaginal comme
nous l'avons démontré pour la première fois chez Cataglyphis
cursor pour les soins aux larves (Isingrini, Lenoir et Jaisson 1985)
puis cela a été confirmé chez Camponotus floridanus
(Carlin and Schwartz 1989, voir aussi Baudoin 2019 p. 102). Cela marche seulement
chez les toutes jeunes larves. Voir
plus
Démonstration
du rôle des hydrocarbures dans la reconnaissance coloniale
- Les tests de confrontation ont été évidemment très
utilisés par tous les auteurs montrant que des fourmis de colonies différentes
se reconnaissent et que l'agressivité entre colonies est corrélée
à la différence entre les profils d'hydrocarbures. C'est le cas
de Cataglyphis cursor (Nowbahari et al 1990).
- Les expériences avec supplémentation ont aussi bien sûr
été réalisées. Seuls les extraits contenant les
hydrocarbures sont efficaces, les extraits de substances plus polaires ne modifient
pas l'agressivité des fourmis. L'ajout d'extraits de fourmis hétérocoloniales
à un individu le rend difficile à reconnaître, et au contraire
un extrait d'une homocoloniale sur une étrangère la rend moins
agressée (Lahav et al 1999). Meskali (et al 1995) ont enduit la cuticule
d'ouvrières Camponotus vagus avec du (Z)-9-tricosène,
alcène naturellement absent dans cette espèce. Cette modification
de la composition des hydrocarbures est suivie d’une augmentation significative
des antennations et des menaces exprimées par des individus non traités
envers leurs congénères traitées. même résultat
chez Camponotus floridanus avec es applications de C23 non présent
naturellement (Brandstaetter et al. 2008). Cela marche aussi sur les abeilles
où l'on ajoute du C32 (Breed 1998) et qi sont capables de différencier
du C23 par rapport à du C27 (Getz & Smith 1987). Chez les termites,
l'ajout de parafines à Retulitermes speratus et Coptotermes
formosanus renforce les agressions (Gassa and Takahashi 1995).
- Les expériences avec des leurres (fourmis mortes) imprégnés
d'extraits au pentane montrent la même chose. Cela a été
fait chez Camponotus vagus (Bonavita-Cougourdan et al. 1987, Morel
et Blum 1988) et chez Cataglyphis cursor (Nowbaharri et al 1990).
Sur le terrain, les cadavres homocoloniaux de Formica montana débarrassés
des lipides cuticulaires (lavage avec des solvants apolaires) sont agressés
alors que des cadavres lavés avec des solvants polaires sont toujours
acceptés (Henderson 1990). Des expériences avec leurres montrant
le rôle des hydrocarbures ont aussi été effectuées
chez les abeilles (Breed et Stiller 1992) et des guêpes parasitoïdes
de fourmis (Liepert et Dettner 1993).
- On a aussi utilisé des billes imprégnées par des hydrocarbures
et cela confirme tous les travaux précédents, par exemple chez
Pogonomyrmex barbatus (Wagner et al. 2000, Green & Gordon 2007),
Formica japonica (Akino et al 2004), Formica xerophila où
l'extrait d'une seule fourmi est suffisant (Tanner 2008).
- Le lavage des individus à l'eau plus ou moins chaude induit des problèmes
de reconnaissance chez les fourmis et les termites. Cela a été
controversé car les lipides ne se dissolvent pas dans l'eau, pourtant
cela modifie sans doute la couche épicuticulaire. Chez les fourmis c'est
connu depuis Piéron (1906), et la confirmation de ces expériences
par Fresneau (1980) chez Neoponera et Roux (et al 2009) chez Camponotus.
Chez les termites c'est aussi connu depuis 1911 (Andrews), puis Matsuura (2001).
Le Masne rapporte des observations
de Bethe (1898) : si on enduit des fourmis d'une colonie A avec un broyat à
l'eau d'une colonie B elles sont tolérées dans B mais de manière
temporaire (in Grassé, X2, p. 1113)
- Chez
les Acromyrmex echiniator du Panama il y a de nombreuses bactéries
dans le tube digestif. Le traitement avec de la tétracycline modifie
un peu le profil des hydrocarbures cuticulaires (pour le C36 et le C40).
Cela entraîne des modifications dans la reconnaissance coloniale (Teseo
et al 2019).
- F. polyctena et F. pratensis sont territoriales et très
agressives et marquent les limites de leur colonie. Sous l'influence du TiO2
l'agressivité change et cela est lié aux modifications du profil
cuticulaire d'hydrocarbures qui sont oxydés en alcools, aldéhydes
et acides carboxyliques (Czekes et al 2022).
Différences
d'hydrocarbures entre colonies
Dans de nombreux exemples il a été montré que les
colonies diffèrent selon leur profil d'hydrocarbures. Chez Cataglyphis
iberica les différences entre colonies de Barcelone et celles de
Murcia étaient très fortes et ensuite il est apparu que c'étaient
des espèces différentes (Dahbi et al 1996) : Barcelone à
gauche et Murcia à droite. En fait celles de Murcia sont une nouvelle
espèce, Cataglyphis gedeai (de Haro et Collingwood 2003). Ceci
a été confirmé avec la biologie moléculaire (Villalata
et al 2018).
Nous avons observé aussi des différences chez Lasius niger avec des colonies provenant d'un même endroit ou de zones très différentes, mais ici c'est toujours la même espèce (Lenoir et al 2009).
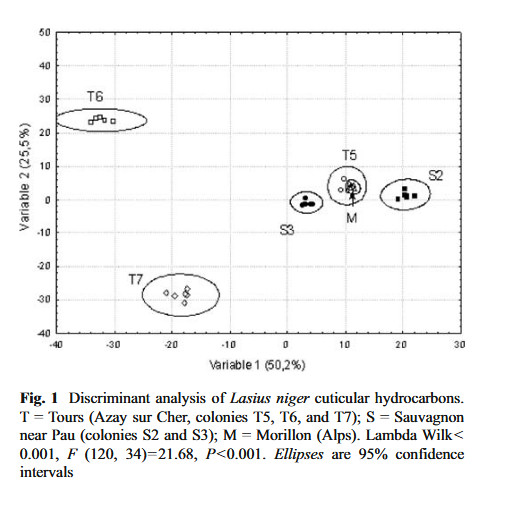
Récemment Firmino (et al 2020) ont confirmé sur 4 colonies d'Ectatomma brunneum de deux régions du Brésil qu'une telle variation est possible.
Chez Aphaenogaster senilis les différences intercoloniales sont peu marquées, et juste significatives (Lenoir et al 2001). Signorotti (et al 2014) ont mesuré les différences d'hydrocarbures entre 9 colonies de Banyuls-sur-Mer, et confirment que cette différence est moins forte puisque seulement 81% des fourmis sont affectées à leur bonne colonie. C'est sans doute lié au mode de reproduction par fission (Ledoux 1971, 1973).
Chez Formica fusca en Belgique la fermeture coloniale n'est pas parfaite. 2,4% des ouvrières peuvent changer de colonie et entrer dans une colonie étrangère génétiquement différente dans des conditions de laboratoire. Elles vont aller dans une colonie dont le profil chimique (hydrocarbures) est proche de la leur. Ce sont les méthyl-alcanes qui semblent être les plus importants. Selon les auteurs, le phénotype d'hydrocarbures s'explique pour 50% par l'environnement et 27,5% par la génétique. Les reines sont le plus souvent accouplées une seule fois (en moyenne 1,19 fois) (Caliari Oliveira et al 2022)
Brachymyrmex patagonicus, espèce d'Afrique du Sud, envahissante dans le sud des USA (depuis 1976, et aussi Asie, Espagne et Martinique), par exemple au Texas. Pourtant, c'est une fourmi qui reste multicoloniale avec des colonies monogynes très agressives entre elles, parfois à moins de 2,5 mètres, avec 400 à 800 colonies /ha. Chaque colonie garde un profil cuticulaire propre bien différencié. L'agression intercoloniale est cependant liée plutôt à la différenciation génétique plutôt qu'aux différences chimiques. Elle est sans doute liée à un petit nombre de composés (Eyer et al 2021).
La
gestalt et le rôle de la
glande postpharyngienne, des trophallaxies
L'odeur coloniale
(Gestalt) permet aux individus de se reconnaître. Bagnères et Morgan
(1991) ont montré que la glande postpharyngienne (PPG) était le
lieu de stockage des hydrocarbures et que ces hydrocarbures sont responsables
de la reconnaissance. On a aussi appliqué le contenu de la PPG sur des
fourmis Cataglyphis niger pour montrer leur rôle dans la reconnaissance
coloniale (Soroker et al 1994). Chez cette espèce C. niger les
hydrocarbures sont synthétisés au niveau de la cuticule et migrent
dans la PPG où ils sont stockés, sans doute en passant par l'hémolympe.
Ils sont ensuite échangés
lors des trophallaxies pour l'établissement d'une odeur coloniale homogène
(Soroker et al 1995). De nombreux travaux ultérieurs ont montré
le rôle des trophallaxies dans la mise en place de la gestalt, par exemple
chez Cataglyphis iberica (Dahbi et al. 1999) et Camponotus fellah
(Boulay et al 2004).
La PPG de Pachycondyla
(C. Lucas) : 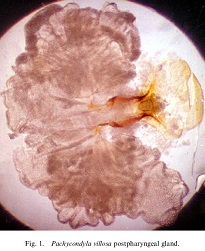
Des controverses sur le rôle de la gestalt
Chez les Formica execta on observe une très forte plasticité
phénotypique dans la reconnaissance coloniale. Les auteurs écrient
"workers adjust their profile to ‘match’ the dominant chemical
profile within that colony, hence maintaining the colony-specific chemotype
and indicates that a ‘gestalt’ mechanism, i.e. profile mixing, plays
no or only a minor role." Que penser de ces travaux ?? Comment les
fourmis "match" leur profil d'hydrocarbures sur celui de la colonie
? Les auteurs n'ont même pas regardé si elles trophallaxaient..
(Martin et al 2019).
Le
rôle des différentes classes d'hydrocarbures
Les différents hydrocarbures sont impliqués dans
la reconnaissance coloniale de manière très variable. Selon les
espèces on parle des méthylalkanes, pour d'autres des alcènes.
En général on considère que les alkanes saturés
qui ont une température de fusion plus élevée, sont plutôt
impiqués dans lutte contre la dessication. Chez Camponotus vagus
ce sont les diméthylalkanes qui sont concernés et expliquent la
variation intercoloniale (Bonavita-Cougourdan et al. 1987).
Chez les Azteca, le profil
global des hydrocarbures cuticulaires n'est pas lié à l'agression,
mais ce sont les alkanes méthylés qui sont responsables de la
reconnaissance (Camarota et al 2021).
Le champignon Rickia wasmanni parasite de Myrmica modifie
la reconnaissance coloniale des hôtes. Il y a chez les fourmis infectées
plus de C23 sur la cuticule, ce qui facilite l'acceptation des fourmis infectées
en diminuant l'agression envers ces fourmis (tests sur des fourmis mortes) (Csata
et al 2022).
L'effet "cher ennemi" démontré chez les fourmis arboricoles Azteca au Brésil (Viçosa). Entre colonies voisines on peut avoir les effets inverses comme le "cher ennemi" ("DE dear enneny") où l'on est moins agressif envers les voisins connus, ou au contraire le "méchant ennemi" (NN nasty-neighbor effect) où l'on est plus agressif envers les voisins (Camarota et al 2021).
L'odeur
des colonies monogynes ou polygynes
L'odeur coloniale peut varier
dans une même espèce selon que les colonies sont monogynes ou polygynes.
C'est le cas chez Messor barbarus (Bonavita-Cougourdan et al. 1987;
Provost et al. 1992).
Profil
cuticulaire sous l'effet des champignons pathogènes
Les abeilles traitées avec le champignon Beauveria bassiana
est très utilisé comme biocide, en particulier dans la culture
bio. Le champignon pénètre dans la cuticule et tue l'insecte rapidement.
Il est considéré comme sans effet sur l'homme et les animaux non
cibles. Rita Cervo et Stefano Turillazi à Florence ont analysé
le profil d'hydrocarbures cuticulaires des abeilles traitées avec le
champignon B. bassiana. Le profil est modifié, en particulier
il y a moins d'alcènes importants dans la reconnaissance coloniale chez
les abeilles, et les abeilles sont plus facilement acceptées dans des
ruches étrangères, ce qui permet la diffusion du champignon pathogène.
Les abeilles peuvent récupérer des spores lors de leur butinage
dans les champs traités au Beauveria. Les auteurs envoient un
signal d'alarme pour inciter à vérifier la non nocivité
des biocides naturels (Cappa et al 2019).
L'odeur
des fourmis Myrmica scabrinodis infectées par le champignon
Rickia.
Ce champigon n'est pas léthal pour les fourmis mais il change leur odeur.
Les ouvrières infectées ont plus de n-C23 et n-C24. Les auteurs
ont ajouté du C23 (le C24 est très minoritaire) à des ouvrières
mortes non infectées et lavées pour enlever leur odeur. Cela réduit
l'aggressivité des fourmis non infectées. Le n-C23 pourrtait donc
agir comme un signal de pacification ("pacifyng") (Csata et al 2023).
Voir Champignons
pathogènes
Profil
cuticulaire et bactéries symbiotes (microbiome)
Le microbiome des abeilles sert aussi à
élaborer les hydrocarbures cuticulaires, et donc à l'identité
coloniale. Chaque colonie possède un microbiome spécifique qui
influe sur les hydrocarbures. Pour le moment on ne sait pas comment cela se
réalise, peut-être en modifiant l’expression des enzymes
utilisées dans la synthèse des hydrocarbures, ou en fournissant
différents composés aux œnocytes où se fait la synthèse
(Vernier et al 2020, voir Rohrbacher 2020).
La
reconnaissance des différentes castes
Selon Passera Les
insectes Rois de l'adaptation (p. 75) "La signature chimique peut
même concerner des sous-castes, Chez ta fourmi Camponotus vagus, comme
chez les autres fourmis, des ouvrières se consacrent à des tâches
extérieures, comme ta récolte alimentaire, pendant que d'autres
restent dans le nid pour soigner la reine et les larves. Ces ouvrières
fourrageuses et nourrices ont une signature commune montrant qu'elles appartiennent
à la même société, mais aussi quelques petites différences
dans leurs hydrocarbures selon qu'elles sont fourrageuses ou nourrices. Si l'on
place une ouvrière nourrice à l'extérieur du nid, elle
est saisie délicatement par une ouvrière fourrageuse, qui la ramène
sur son lieu de travail à l'intérieur du nid. À chacun
sa place selon son travail !". D'après Bonavita-Cougourdan
et al 1993.
Odeur
coloniale et matériaux du nid
Selon Mathieu
Lihoreau chez les abeilles "l'odeur des matériaux du nid
est un élément clé de l'identité chimique des abeilles"
(p.60). Les odeurs des ruches voisines sont proches et les abeilles peuvent
changer de ruche et "mon formateur en apiculture vaporise du pastis
dilué dans ses ruches pour masquer leurs odeurs coloniales."
(p.61).
Odeur
des fourmis nouveau-nées
Les fourmis à
l'émergence n'ont que très peu d'odeur, elle
va se développer dans les jours qui suivent.
Miss Fielde avait déjà en 1905 émis l'hypothèse
d'un changement progressif d'odeur des fourmis avec l'âge. Soroker (Soroker
et al 1995) ont montré que la quantité d'hydrocarbures accroit
avec l'âge dans la glande postpharyngienne. Nous avons montré que
la même chose existe chez Cataglyphis iberica avec un "callow"
profil (Dahbi et al 1998). Chez Manica rubida et Formica selysi
les deux espèces ont très vite (au bout de 2 jours) leur profil
d'hydrocarbures et que la quantité s'accroit progressivement pour atteindre
son maximum à l'âge de deux mois (Errard 1994, Errard & Jaisson
1991).
Selon Mille
milliards de fourmis : 
Divers
Forel 1874 : des fourmis Formica pratensis séparées depuis
4 mois se reconnaissent mais avec des signes de défiance momentanés
(p. 285-287). Lubbock en 1993 a fait les mêmes observations avec des Formica
fusca séparées; après un an et 9 mois elles se reconnaissent.
Pline l'ancien, dans son Histoire des animaux
avait déjà noté que les fourmis se reconnaissent "Elles
ont leurs jours de marché pour se reconnaître publiquement."
On vient de découvrir que l'acide formique peut intervenir dans la discrimination coloniale chez Camponotus aethiops en accroissant la quantité d'information disponible, et en conséquence en diminuant le chevauchement de phénotype entre nestmates et non-nestmates (Rossi et al 2019).
Selon À quoi pensent les abeilles ? de Mathieu Lihoreau : chez les abeilles "l'odeur des matériaux du nid est un élément clé de l'identité chimique des abeilles" (p.60). Les odeurs des ruches voisines sont proches et les abeilles peuvent changer de ruche et "mon formateur en apiculture vaporise du pastis dilué dans ses ruches pour masquer leurs odeurs coloniales." (p.61).
De Rienzi a écrit dans son livre de science-fiction "Les Formiciens" (1932) que les formiciens se reconnaissent à l'odeur et qu'elles ont besoin de se nettoyer leurs antennes pour que cela reste efficace.
Dans les archives du palais de la Découverte : Dessine-moi les sciences. Histoire de fourmis. (Lien) :
Dans la science-fiction de Theodore Sturgeon, M. Costellos, Héros. Il veut rendre des fourmis à 8 pattes d'une même colonie agressives entre elles.
Dans le livre de Cortès Par la force des arbres (2020) : "À l'entrée d'une fourmilière des gardes veillent nuit et jour. Un mot de passe permet d'entrer dans la forteresse. Le code s'échange d'un baiser chimique sur la bouche. Si le baiser n'est pas le bon, les soldats interviennent en nombre contre l'intrusion d'autres fourmis venues piller le palais."
Selon Fourmi
verte (1994) : 
Voir
- Boulay,
R. and A. Lenoir (1998). Influence de l'isolement social chez la fourmi Camponotus
fellah (Hymenoptera: Formicidae). Actes Coll.Insectes Soc. 11: 33-35. Pdf
- Boulay,
R., T. Katzav-Gozansky, A. Hefetz and A. Lenoir (2004). Odour convergence and
tolerance between nestmates through trophallaxis and grooming in the ant Camponotus
fellah (Della Torre). Insectes Sociaux 51: 55-61. Pdf
- Dahbi, A., X. Cerdá, A. Hefetz and A. Lenoir (1996). Social closure,
aggressive behavior, and cuticular hydrocarbon profiles in the polydomous ant
Cataglyphis iberica (Hymenoptera, Formicidae). Journal of Chemical Ecology 22:
2173-2186. Pdf
- Dahbi, A., X. Cerdá and A. Lenoir (1998). Ontogeny of colonial hydrocarbon
label in callow workers of the ant Cataglyphis iberica. Compte Rendus Académie
des Sciences Paris 321: 395-402. Pdf
- Dahbi, A., A. Hefetz, X. Cerdá and A. Lenoir (1999). Trophallaxis mediates
uniformity of colonial odor in Cataglyphis iberica ants (Hymenoptera, Formicidae).
Journal of Insect Behavior 12: 559-567. Pdf
- d'Ettorre, P. and A. Lenoir (2010). Nestmate recognition in ants. Ant Ecology.
L. Lach, C. Parr and K. Abbott. Oxford, Oxford University Press: 194-209. Pdf
- Lenoir, A. (1981). Brood retrieving in the ant Lasius niger L. Sociobiology
6: 153-178. Pdf
- Lenoir,
A. (1984). Brood-colony recognition in Cataglyphis
cursor worker ants (Hym. Form.). Animal Behaviour 32: 942-944. Pdf
- Lenoir, A., D. Cuisset and A. Hefetz (2001). Effects of social isolation
on hydrocarbon pattern and nestmate recognition in the ant Aphaenogaster senilis
(Hymenoptera: Formicidae). Insectes Sociaux 48(2): 101-109. Pdf
- Lenoir, A., S. Depickère, S. Devers, J.-P. Christidès
and C. Detrain (2009). Hydrocarbons in the ant Lasius niger: From the cuticle
to the nest and home range marking. Journal of Chemical Ecology 35(8): 913-921.
Pdf
- Nowbahari E, Lenoir A, Clément J-L, Lange C, Bagnères
A-G, Joulie C (1990) Individual, geographical and experimental variation of
cuticular hydrocarbons of the ant Cataglyphis cursor (Hymenoptera: Formicidae):
Their use in nest and subspecies recognition. Biochem System Ecol 18:63-73.
Pdf
- Rohrbacher, F. (2020). Les abeilles domestiques s'identifient grâce
à leur microbiome. Le Monde Science et Médecine. 28 octobre 2020.
Pdf
(voir texte)
- Akino, T., N. Yamamura,
S. Wakamura and R. Yamaoka (2004). Direct behavioral evidence for hydrocarbons
as nestmate recognition cues in Formica japonica (Hymenoptera: Formicidae).
Applied Entomol. Zool. 39: 381-387.
- Andrews, E. A. (1911). Observation on termites in Jamaica. Journal of Animal
Behavior 1: 193-228.
-
Ayari, A., F.-J. Richard, C. Souty-Grosset and K. Nasri-Ammar (2016). Family
identity of the sub-social desert terrestrial isopod Hemilepistus reaumurii.
Journal of Arid Environments 134: 10-16.
- Bagnères, A.-G. and E. D. Morgan (1990). A simple method for analysis
of insect cuticular hydrocarbons. Journal of Chemical Ecology 16: 3263-3276.
- Bagnères, A. G. and E. D. Morgan (1991). The postpharyngeal glands
and the cuticle of Formicidae contain the same characteristic hydrocarbons.
Experientia 47: 106-111.
- Baudoin, C. (2019). A quoi pensent les animaux ? Biblis.
- Bonavita-Cougourdan A, Clément J-L, Lange C (1987) Nestmate recognition:
the role of cuticular hydrocarbons in the ant Camponotus vagus Scop. J Entomol
Sci 22:1-10
- Bonavita-Cougourdan, A., G. Theraulaz, A.-G. Bagnères, M. Roux, M.
Pratte, E. Provost and J.-L. Clément (1991). Cuticular hydrocarbons,
social organization and ovarian development in a polistine wasp: Polistes dominulus
Christ. Comp. Biochem. Physiol. B 100: 667-680
- Bonavita-Cougourdan, A., J.-L. Clément and C. Lange (1993). Functional
subcaste discrimination (foragers and brood-tenders) in the ant Camponotus vagus
Scop.: polymorphism of cuticular hydrocarbon patterns. Journal of Chemical Ecology
19: 1461-1477.
- Brandstaetter, A. S., A. Endler and C. J. Kleineidam (2008). Nestmate recognition
in ants is possible without tactile interaction. Naturwissenschaften 95: 601-608.
- Breed, M. D. and T. M. Stiller (1992). Honey bee, Apis mellifera, nestmate
discrimination: hydrocarbon effects and the evolutionary implications of comb
choice. Anim.Behav. 43: 875-883.
-
Caliari Oliveira, R., J. van Zweden and T. Wenseleers (2022). Similarities in
Recognition Cues Lead to the Infiltration of Non-Nestmates in an Ant Species.
Journal of Chemical Ecology 48(1): 16-26. doi: 10.1007/s10886-021-01325-3.
-
Camarota, F., R. Campos and D. Vidal (2021). The dear enemy effect drives conspecific
aggressiveness in an Azteca/Cecropia system. Scientific Reports. doi: 10.1038/s41598-021-85070-3
- Cappa,
F., I. Petrocelli, F. R. Dani, L. Dapporto, M. Giovannini, J. Silva-Castellari,
S. Turillazzi and R. Cervo (2019). Natural biocide disrupts nestmate recognition
in honeybees. Scientific Reports 9(1): 3171. 10.1038/s41598-019-38963-3
- Carlin, N. F.
and P. H. Schwartz (1989). Pre-imaginal experience and nestmate brood recognition
in the carpenter ant, Camponotus floridanus. Animal Behaviour 38: 89-95.
- De Rienzi, R. (1932).
Les Formiciens, éditions Tallandier, réédition 1984, NéO.
- Crozier, R. H. and M. W. Dix (1979). Analysis of two genetic models for the
innate components of colony odor in social Hymenoptera. Behav. Ecol. Sociobiol.
4: 217-224
- Csata, E., L. Casacci, J. Ruther, A. Bernadou, J. Heinze and B. Markó
(2022). What does not kill you makes you peaceful: non-lethal fungal infection
could reduce aggression towards strangers in ants. Research Square. doi: 10.21203/rs.3.rs-1305759/v1.
-
Csata, E., L. P. Casacci, J. Ruther, A. Bernadou, J. Heinze and B. Marko (2023).
Non-lethal fungal infection could reduce aggression towards strangers in ants.
Communications Biology 6. 10.1038/s42003-023-04541-7
- Czekes, Z.,
D. Bai, J. Vincze, G. Emese, Z. Nagy, L. Baia and Z. Pap (2022). Commercial
photocatalyst changes the behavior of Formica pratensis and Formica polyctena.
Environmental Science: Nano. doi: 10.1039/d1en01119g.
- de Haro, A. and C. A. Collingwood (2003). Cataglyphis gadeai sp. nov. (Hym.
Formicidae), del grupo albicans de color negro del Cabo de Gata (Almería),
SE de España. Orsis 18: 19-27.
- Errard, C. and P. Jaisson (1991). Les premières étapes de la
reconnaissance interspécifique chez les fourmis, Manica rubida et Formica
selysi (Hymenoptera: Formicidae) élevées en colonies mixtes. C.
R. Acad. Sc. Paris (D) 313, sér III: 73-80.
- Errard, C. (1994). Development of interspecific recognition behavior in the
ants Manica rubida and Formica selysi (Hymenoptera: Formicidae) reared in mixed-species
groups. Journal of Insect Behavior 7(1): 83-99.
-
Eyer, P.-A., P. T. Shults, M. R. Chura, M. N. Moran, M. N. Thompson, A. M. Helms,
R. K. Saran and E. L. Vargo (2021). Divide and conquer: Multicolonial structure,
nestmate recognition, and antagonistic behaviors in dense populations of the
invasive ant Brachymyrmex patagonicus. Ecology and Evolution n/a(n/a). doi:
https://doi.org/10.1002/ece3.7396
- Fielde, A. M. (1901). A study of an ant. Proc. Acad. Nat. Sci. Phila. 53:
425-449.
- Fielde, A. M. (1903). Supplementary notes on an ant. Proc. Acad. Nat. Sci.
Phila. 55: 491-495.
- Fielde, A. M. (1905). The progressive odor of ants. Biol. Bull. Marine Lab.,
Woods Hole 10(1): 1-16.
- Firmino,
E. L. B., A. Mendonça, K. B. Michelutti, R. C. Bernardi, S. E. Lima-Junior,
C. A. L. Cardoso and W. F. Antonialli-Junior (2020). Intraspecific variation
of cuticular hydrocarbons and apolar compounds in the venom of Ectatomma brunneum.
Chemoecology. doi: 10.1007/s00049-020-00309-1.
-
Forel, A. (1874). Fourmis de la Suisse, H. Georg.
- Fresneau, D. (1980). Fermeture des societes et marquage territorial chez les
fourmis Ponerines du genre Neoponera. Biologie Ecologie Méditerranéenne
7: 205-206.
- Gassa, A. and S. Takahashi (1995). Effects of modification of cuticular hydrocarbon
composition on the recognition behavior of termites. Jpn.J.Environ.Entomol.Zool.
7(2): 64-71.
- Greene, M. J. and D. M. Gordon (2007). Structural complexity of chemical recognition
cues affects the perception of group membership in the ants Linephithema humile
and Aphaenogaster cockerelli. J Exp Biol 210(Pt 5)
- Henderson G, Anderson JF, Phillips JK, Jeanne RL (1990) Internest aggression
and identification of possible nestmate discrimination pheromones in polygynous
ant Formica montana. J Chem Ecol 16:2217-2228
- Howse, P. E. (1975). Chemical defenses of ants, termites and other insects:
some outstanding questions. Pheromones and defensive secretions in social insects.
C. Noirot, P. E. Howse and G. Le Masne, University Dijon, France: 23
- Kaib, M., B. Eisermann, E. Schoeters, J. Billen, S. Francke and W. Francke
(2000). Task related variation of postpharyngeal and cuticular hydrocarbon compositions
in the ant Myrmicaria eumenoides. J. Comp. Physiol. A 186: 939-948.
- Kather, R., F. Drijfhout and S. Martin (2011). Task Group Differences in Cuticular
Lipids in the Honey Bee Apis mellifera. Journal of Chemical Ecology 37(2): 205-212.
- Lahav, S., V. Soroker, A. Hefetz and R. K. Vander Meer (1999). Direct behavioral
evidence for hydrocarbons as ant recognition discriminators. Naturwissenschaften
86: 246-249.
- Ledoux, A. (1971). Un nouveau mode de bouturage de société chez
la fourmi Aphaenogaster senilis Mayr. C R Acad Sci Paris 273D: 83-85
- Ledoux, A. (1973). A propos du bouturage de société chez la
fourmi Aphaenogaster senilis Mayr. Compte Rendus Académie des Sciences
Paris 277D: 2199-2200
- Martin,
S. J., F. P. Drijfhout and A. G. Hart (2019). Phenotypic Plasticity of Nest-Mate
Recognition Cues in Formica exsecta Ants. Journal of Chemical Ecology 45(9):
735-740. 10.1007/s10886-019-01103-2
- Matsuura, K. (2001). Nestmate recognition mediated by intestinal bacteria
in a termite, Reticulitermes speratus. Oikos 92: 20-26.
- Lubbock, J. (1883). Fourmis, Abeilles et Guêpes, Librairie Germer Baillère
et Cie. 196p.
- Martin, S. J. and F. P. Drijfhout (2009). Nestmate and task cues are influenced
and encoded differently within ant cuticular hydrocarbon profiles. Journal of
Chemical Ecology: DOI 10.1007/s10886-10009-19612-x.
- Meskali M, Bonavita-Cougourdan A, Provost E, Bagnères A-G, Dusticier
G, Clément J-L (1995) Mechanism underlying cuticular hydrocarbon homogeneity
in the ant Camponotus vagus (Scop.) (Hymenopetra: Formicidae): role of postpharyngeal
glands. J Chem Ecol 21:1127-1148
- Morel, L. and M. S. Blum (1988). Nestmate recognition in Camponotus floridanus
callow worker ants : are sisters or nestmates recognized ? Anim.Behav. 36: 718-725.
- Piéron, H. (1906). Le mécanisme de la reconnaissance chez les
fourmis. Rôle des données olfactives. Compte Rendu des Séances
de la Société de Biologie 61: 471-473.
- Provost, E., P. Cerdan, A.-G. Bagnères, E. D. Morgan and G. Rivière
(1992). Role of the queen in Messor barbarus colony signature. Biology and Evolution
of social insects. J. Billen. Leuven, Belgium, Leuven University Press: 195-202.
- Richard,
F.-J. (2017). Symbiotic Bacteria Influence the Odor and Mating Preference of
Their Hosts. Frontiers in Ecology and Evolution 5(143). 10.3389/fevo.2017.00143.
Libre de droits
- Rossi,
N., D. Baracchi, M. Giurfa and P. d’Ettorre (2019). Pheromone-Induced
Accuracy of Nestmate Recognition in Carpenter Ants: Simultaneous Decrease in
Type I and Type II Errors. The American Naturalist in press(0): 000-000. 10.1086/701123
- Roux, O., J.-M. Martin, N. Ghomsi and A. Dejean (2009). A Non-lethal Water-based
Removal-reapplication Technique for Behavioral Analysis of Cuticular Compounds
of Ants. Journal of Chemical Ecology 35(8): 904-912.
- Scholl, J. and D. Naug (2011). Olfactory discrimination of age-specific hydrocarbons
generates behavioral segregation in a honeybee colony. Behavioral Ecology and
Sociobiology, Springer Berlin / Heidelberg: 1-7.
-
Signorotti, L., P. Jaisson and P. d'Ettorre (2014). Larval memory affects adult
nest-mate recognition in the ant Aphaenogaster senilis. Proceedings
of the Royal Society B: Biological Sciences 281(1774). 10.1098/rspb.2013.2579
- Soroker, V., C. Vienne, A. Hefetz and E. Nowbahari (1994). The postpharyngeal
gland as a "gestalt" organ for nestmate recognition in the ant Cataglyphis
niger. Naturwissenschaften 81: 510-513.
- Soroker, V., C. Vienne and A. Hefetz (1995). Hydrocarbon dynamics within and
between nestmates in Cataglyphis niger (Hymenoptera, Formicidae). Journal of
Chemical Ecology 21: 365-378.
- Soroker, V., A. Hefetz, M. Cocojaru, J. Billen, J. Francke and W. Francke
(1995). Structural and chemical ontogeny of the postpharyngeal gland in the
desert ant Cataglyphis niger. Journal of Chemical Ecology 20: 323-329.
- Tanner, C. J. (2008). Aggressive group behaviour in the ant Formica xerophila
is coordinated by direct nestmate contact. Animal Behaviour 76(4): 1335-1341.
- Teseo,
S., J. S. van Zweden, L. Pontieri, P. W. Kooij, S. Sørensen, T. Wenseleers,
M. Poulsen, J. J. Boomsma and P. Sapountzis (2019). The scent of symbiosis:
gut bacteria may affect social interactions in leaf-cutting ants. Anim Behav
150: 239-254. 10.1016/j.anbehav.2018.12.017
-
Vernier, C. L., I. M. Chin, B. Adu-Oppong, J. J. Krupp, J. Levine, G. Dantas
and Y. Ben-Shahar (2020). The gut microbiome defines social group membership
in honey bee colonies. Science Advances 6(42): eabd3431. doi: 10.1126/sciadv.abd3431.
- Villalta, I., F. Amor, J. A. Galarza, S. Dupont, P. Ortega, A. Hefetz, A.
Dahbi, X. Cerdá and R. Boulay (2018). Origin and distribution of desert
ants across the Gibraltar Straits. Molecular Phylogenetics and Evolution 118:
122-134. doi: https://doi.org/10.1016/j.ympev.2017.09.026.
- Wagner, D., M. J. F. Brown, P. Broun, W. Cuevas, L. E. Moses, D. L. Chao and
D. M. Gordon (1998). Task-related differences in the cuticular hydrocarbon composition
of harvester ants, Pogonomyrmex barbatus. J. Chem. Ecol. 24: 2021-2037.
- Wagner, D., M. Tissot, W. Cuevas and D. M. Gordon (2000). Harvester ants utilize
cuticular hydrocarbons in nestmate recognition. Journal of Chemical Ecology
26: 2245-2257.