Hydrocarbures
cuticulaires 
Alain Lenoir - Mis à jour le 26-Jui-2023
Hydrocarbure : composé organique constitué exclusivement d’atomes de carbone et d’hydrogène. Ce sont des composés issus des produits pétroliers et des cires de l'épicuticule des végétaux. Les alcanes sont des hydrocarbures produits aussi par des cyanobactéries marines en grande quantité, entre 300 et 800 millions de tonnes par an !! Penser à une récolte possible ? (Jonhson 2019). D'autres bactéries comme Alcanivorax borkumensis, bactérie marine non pathogène, mangeuse de pétrole, dégradent les hydrocarbures (comme le benzène, le toluène, le xylène) avec des estérases en CO2 et l'eau. Et si on regardait ce qui se passe sur la cuticule des fourmis avec ces bactéries ?
On les trouve aussi sur la cuticule des arthropodes, et donc des fourmis. Ils servent essentiellement à protéger contre la dessication et permettent la reconnaissance coloniale (voir d'Ettorre et Lenoir 2010). Laurent Keller et une équipe japonaise ont découvert qu'une hormone peptidique, l'inotocine ("oxytocin-vasopressin like", vous connaissiez ?) est responsable du changement de comportement en fonction de l'âge. Le taux d'hormone augmente avec l'âge et quand elle atteint un certain seuil la fourmi devient pourvoyeuse. Avec l'âge, jusqu'à 7 mois, l'augmentation du taux d'hormone change la composition de la cuticule et la surface du corps devient plus résistante à la sécheresse en jouant sur la synthèse des hydrocarbures. Ce sont surtout les alcanes linéaires qui sont modifiés, ce qui correspond bien à une augmentation de la résistance de la cuticule à la sécheresse (Koto et al 2019, voir Coulon 2019, Meurisse 2019). Gros et beau travail ...
Pour les analyser on utilise la spectrométrie de masse. Rémy Chauvin en 1988 (Voir texte) était déjà admiratif de ces nouvelles technologies. Pour extraire les hydrocarbures il faut un solvent comme le pentane ou l'hexane et passer l'extrait dans un chromaographe en phase gazeuse couplé à un spectromètre de masse. Il existe une nouvelle méthode qui permet de distinguer les hydrocarbures (sans identication je crois), la spectroscopie photoacoustique à infrarouges (Antonialli et al. 2008a; 2008b) qui permet de séparer les profils des espèces, des colonies et des castes.
Les hydrocarbures sont saturés (alkanes, méthylalkanes) ou avoir des doubles liaisons (alcènes). Voir les différents types (Barbero 2016).
Hydrocarbures des insectes en collection en épingles dans les musées. Chez la guêpe Odynerus spinipes l'étude des hydrocarbures permet dans 90% des cas l'identification de l'échantillon. Certains échantillons avaient jusqu'à 200 ans (Moris et al 2021). La conservation des HCs à sec est donc très stable.
Le rôle des protéines cuticulaires volatiles dans les contacts "body shaking" chez les termites Reticulitermes flavipes. Les reproducteurs ont plus de protéines différentes que les ouvriers et une composition spécifique. Ces résultats préliminaires montrent que la communication n'est pas limitée aux hydrocarbures (Ruhland et al 2023). Interesting.
Plus sur les hydrocarbures :
Hydrocarbures
et résistance à la dessication
La conservation
de l'eau est un problème pour tous les organismes terrestres, en particulier
pour les plus petits. L'évaporation d'eau est fonction de la surface
du corps et la surface est proportionnellement plus grande pour les organimses
plus petits (Hood & Tschinkel 90). Avec le réchauffement
climatique on se demande comment les fourmis vont réagir.
Il y a un travail sur deux espèces de Temnothorax qui montre
par exemple qu'avec la chaleur il y des alcanes plus lourds (Menzel et al 2018).
Les bactéries symbiontes aident la synthèse de cuticule et la
sclérotisation qui permettent la résistance à la dessication
(voir de Souza et al 2011).
Le point de fusion varie selon les hydrocarbures : les alkanes saturés sont les plus résistants, ensuite les branchés puis les akènes. Les alkanes branchés varient selon la position terminale (3 ou 5ème) qui sont plus résistants à la chaleur ou interne (9, 11 ou 13) qui le sont moins (Lucas et al 2004; Sprenger et al 2021).
La cuticule
selon Holze (2021) : 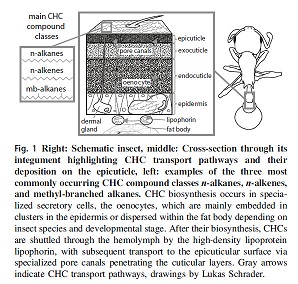
Les effets de la température sur l'odeur des fourmis Odontomachus. On sait que les hydrocarbures sont une barrière physique contre la dessication. Les auteurs brésiliens (Santos et al 2022) ont placé des Odontomachus à des températures différentes en laboratoire (15, 25 et 35°C). Ils ont ensuite fait des tests de reconnaissance et extrait les hydrocarbures. Les antennations sont plus longues de la part des fourmis normales (25°C) envers celles qui ont été soumises au traitement thermique, ce qui suggère des difficultés de reconnaisance. Cela s'accompagne de modifications significatives du profil d'HCs, en particulier une augmentation des chaînes plus longues. L'hexacosane (C26) et l'octocosane (C28) qui ne sont pas présents chez les témoins apparaissent chez les traités. Il faut remarquer que ces fourmis n'ont que très peu d'hydrocarbures, seulement une vingtaine, de C18 à C32 (68% d'alcanes linéaires, 18% de methyls et 13,4% d'alcènes). Ce phénomène est peut-être une caractéristique des fourmis tropicales qui vivent en atmosphère saturée d'humidité. En effet ce n'est pas vrai pour 85 espèces de Crematogaster et Camponotus de diverses régions du monde (Menzel et al 2017).
Interaction
entre dessication et reconnaissance coloniale
Chez Lasius
niger et L. platythorax. Travail sur le rôle des HCs qui
protègent contre la dessication et servent de signal pour la reconnaissance
des congénères. Pour la protection contre la dessication il faut
s'ajuster à la température ambiante et cela peut poser des problèmes
de reconnaissance. Des fragments de colonies des deux espèces de Lasius
ont été exposés à 3 régimes climatiques et
cela change leur profil. Seuls un petit nombre d'HCs est utilisé pour
la reconnaissance coloniale. Les deux espèces réagissent différemment,
sans doute lié à leur adaptation aux différents biotopes
(L. niger plutôt dans des sols ouverts, L. platythorax
en forêt). L. niger a surtout des mono-méthyl et n-alcanes,
alors que L. platythorax a surtout des triméthyl alcanes (Wittke
et al 2022).
Volatilité
des hydrocarbures
Contrairement
à ce que l'on pensait, les hydrocarbures saturés (alkanes C20
à C35) se retrouvent dans l'atmosphère sur les microparticules.
On en a mesuré en Inde de 50 à 850ng/m3 (Shivani et al 2018, Gadi
et al 2019). On en retrouve aussi dans le sol de zones hyper polluées
comme à Lacq. Tout individu dégage en permanence des hydrocarbures
qui sont perçus par les autres. Cela a été montré
chez les abeilles qui sont vite détectées à leur mort,
en effet elles ont moins d'odeur (moins d'hydrocarbures) et seront donc évacuées
de la ruche (Wen 2020, voir Solé 2020) (voir nécrophorèse).
Une étude a été effectuée sur la viscosité
des hydrocarbures sur 11 espèces de fourmis. Ils sont complètement
liquides à 40°C. Certains profils différents peuvent avoir
des viscosités comparables, ce qui signifie qu'ils sont adaptatifs et
que les signaux de communication sont perçus indépendemment du
profil (Menzel et al 2019).
Hydrocarbures
et reconnaisance coloniale / spécifique
On connait bien maintenant le rôle
des hydrocarbures dans la reconnaissance coloniale - voir
reconnaissance coloniale
Les
hydrocarbures sont de très bons marqueurs du genre ou de l'espèce
(0% d'erreurs) sur deux Temnothorax et deux Myrmica (M.
rubra et M ruginodis) (Sprenger et Menzel 2020). Idem pour 17
espèces de Lasius, Formica et Myrmica
(Sprenger et al 2021).
Les hydrocarbures sont souvent un bon indice de marquage d'espèces cryptiques
difficilement identifiables par la morphologie. Dans certains cas, il peut y
avoir des variations intercoloniales suffisamment fortes pour faire penser à
des espèces différentes. C'est le cas pour Cataglyphis iberica
entre Barcelone et Murcia, et en fait il s'agissait d'espèces différentes.
Des espèces peuvent parfois s'hybrider. C'est le cas de Tetramorium
immigrans et T. caespitum qui ont des profils d'hydrocarbures
bien différents et sont très agressives entre espèces.
Ces fourmis peuvent s'hydrider et ont un mélange des deux espèces
pour former un profil spécifique avec des agressions (Cordonnier et al
2019).
Selon Witkke et al (2022) seuls un petit nombre d'HCs est utilisé pour
la reconnaissance coloniale chez Lasius niger et L. platythorax.
Chez la tique Ixodes, parasite d'oiseaux, ils varient en Islande selon
l'espèce d'oiseau hôte, puffin ou guillemot, reflétant des
différences de populations (Dupraz et al 2022).
Hydrocarbures
et marquage territorial, marquage du nid
Les fourmis déposent
les hydrocarbures sur le substrat où elles passent à partir des
tarses des pattes. Les hydrocarbures se retrouvent dans les matériaux
du nid. On en retrouve
chez
Lasius niger dans
le nid en grande quantité. Il n'y a pas de spécificité
coloniale, il y a saturation et cela explique sans doute que des fourmis étrangères
soient acceptées plus facilement quand elles ont réussi à
forcer le barrage de l'entrée du nid. Les hydrocarbures sont aussi déposés
à l'entrée du nid et dans l'aire de fourragement avec une quantité
d'alcanes plus importante. Les alcanes branchés (méthyls) sont
typiques de la colonie et permettent le marquage territorial (Lenoir
et al 2009).
En
Californie le bourdon Bombus impatiens peut être en compétition
avec la fourmi d'Argentine dans la pollinisation : ils consomment moins de nectar. Ils
perçoivent les odeurs (CHs des pattes ou du corps, phéromone d'alarme
((Z)-9-Hexadécanal) des fourmis et cela les perturbe. Cela confirme le
rôle néfaste de cette fourmi (Miner et al 2023).
Mestre (et al 2020) ont montré que certaines araignées perçoivent
ces traces de Lasius niger. Chez
le frelon asiatique ils
sont marqueurs de l'identité coloniale (Haouzi et al 2021).
Variations
de l'odeur selon les parties du corps
Il n'y a pas de
variation de substances selon les endroits du corps chez 5 espèces de
fourmis (Bagnères et Morgan 1990), mais chez Camponotus
vagus les proportions relatives d'alkanes branchés varient entre
la tête et le thorax dans un même nid (Bonavita-Cougourdan et al.
1987). Chez Lasius fuliginosus, même chose : le thorax présente
un profil signicativement différent, mais avec les mêmes substances
(Akino and Yamaoka 2002).
Chez Lasius niger aussi les pattes sont légèrement différentes
en proportion par rapport au corps avec plus de n-alcanes (Lenoir et al 2009).
Il en est de même pour 17 espèces de Lasius, Formica et
Myrmica dont les proportions varient selon les parties du corps (Sprenger
et al 2021).
Les
variations dans la colonie (âge, sous-castes)
Dans la colonie on trouve des différences dans le profil
d'hydrocarbures des ouvrières.
La quantité d'HCs varie en fonction de l'âge. Les ouvrières
nouveau-nées ont très peu d’HCs à l’émergence
et peuvent être transférées dans une autre colonie de la
même espèce et même d’une autre espèce. Je l'ai
fait souvent pendant ma thèse d'Etat pour renforcer des colonies de
Lasius niger (Lenoir 1979).
Cela a permis de faire des colonies mixtes
de Manica rubida et Formica selysi (Errard 1994). La quantité
d’HCs croit régulièrement avec l'âge pour atteindre
le niveau des ouvrières matures. Cela prend 20 jours chez Aphaenogaster
senilis (Ichinose et Lenoir 2009),
10 jours chez Cataglyphis iberica (Dahbi et al 1998). Chez la guêpe
Polistes cela se fait en 3 jours (Lorenzi et al 2004a).
Chez l'abeille,
le profil des ouvrières fourragères change avec l'âge en
fonction du milieu, donc le profil génétiquement-dépendant
serait aussi très âge-dépendant, donc fonction du mieu aussi
(Vernier et al 2019).
Le profil d'hydrocarbures des mâles d'abeille change avec l'âge
et comporte plus d'alkanes saturés et d'alcènes (signe classique
de vieillissement pour les alkanes), et 9 substances volatiles (la plupart non
identifiées) permettant sans doute au moins en partie l'attractivité
pour former les regroupements de mâles au moment de l'essaimage (Voir
Essaimage).
Chez les abeilles eusociales Tetragonisca il y a une différenciation
des castes par les hydrocarbures. Les gardiennes ont plus d'alkanes branchés
que les nourrices ou les fourrageuses. Les colonies ont aussi un peu de différences
selon leurs profils. On trouve aussi chez tous les individus des terpènes
de poids moléculaire élevé, mais ils ne sont pas analysés
(Balbuena et al 2017).
Chez Camponotus vagus il y a des différences entre ouvrières à l'intérieur du nid et les fourrageuses (Bonavita-Cougourdan et al. 1993). Cela est vérifié aussi chez d'autres espèces comme Myrmicaria (Kaib et al. 2000) et Pogonomyrmex barbatus (Wagner et al. 1998) où les ouvrières fourrageuses ont plus d'alkanes saturés sur leur cuticule. Idem chez 3 espèces de Formica (F exsecta, pratensis, lemani) et Lasius niger (Martin and Drijfhout 2009). Chez les abeilles c'est la même chose (Kather et al. 2011, Scholl & Naug 2011).
Les hydrocarbures de Formica exsecta. Une étude qui suit l'évolution des hydrocarbures des cocons et des nymphes jusqu'à l'ouvrière adulte. L'ouvrière a un profil simple, moitié d'alcènes et moitié d'alkanes (C25, C27 et C29). Le cocon porte bien plus de substances que la nymphe, en particulier des diméthyls légers (C16, C17). Les reines, les ouvrières et les mâles ne sont pas différents (Pulliainen et al 2021).
L'odeur des fourmis Myrmica scabrinodis infectées par le champignon Rickia. Ce champigon n'est pas léthal pour les fourmis mais il change leur odeur. Les ouvrières infectées ont plus de n-C23 et n-C24. Les auteurs ont ajouté du C23 (le C24 est très minoritaire) à des ouvrières mortes non infectées et lavées pour enlever leur odeur. Cela réduit l'aggressivité des fourmis non infectées. Le n-C23 pourrtait donc agir comme un signal de pacification ("pacifyng") (Csata et al 2022).
Les cadavres et les tâches fécales
Les cadavres dans le nid ont un profil chimique particulier
qui déclenche des comportements hygiéniques, de rejet du cadavre.
Voir Cimetières
Grasso (et al 2005) ont analysé les tâches fécales de Messor capitatus à l'extérieur du nid. Elles ont le même profil que les sacs restaux et les hydrocarbures cuticulaires, typiques de la colonie.
Héritabilité
des hydrocarbures
Les hydrocarbures sont considérés comme étant très
fortement liés à l'hérédité (de nombreux
travaux, surtout sur la drosophile, par exemple Holze 2021). Pourtant chez Monomorium
pharaonis en élevage au laboratoire les hydrocarbures ont peu
d'héritabilité, ce qui semble indiquer qu'ils sont sujets à
sélection. C'est sans doute ce qui explique qu'en élevage en laboratoire
ils varient facilement, au moins chez les fourmis invasives (Walsh et al 2019).
Chez Formica fusca le phénotype d'hydrocarbures s'explique pour
50% par l'environnement et 27,5% par la génétique (Caliari Oliveira
et al 2022).
Perception
des hydrocarbures
Avec électroantennographie
on montre chez Camponotus floridanus la grande sensibilité aux
divers hydrocarbures cuticulaires (Sharma et al. 2015).
Hydrocarbures
des parasites et myrmécophiles
Les parasites
et autres intrus dans la société comme les myrmécophiles
doivent contourner la barrière de l'identité coloniale. Il y a
plusieurs moyens de le faire. Voir Myrmécophiles
Un exemple de parasite : M.
karavajevi ont le même profil d'hydrocarbures cuticulaires que
leur hôte. On ne sait pas comment cela apparait. Voir
parasitisme social
Hydrocarbures
des prédateurs
Formica archboldi sont prédatrices d'Odontomachus
en Floride en utilisant l'acide formique. Elles collectionnent les têtes
de leur victimes. Elles ont la même odeur que leurs proies (hydrocarbures
cuticulaires), ce qui leur permet de passer inaperçues (Smith 2018, voir
Dailygeekshow (2018). A l'inverse, les araignées errantes perçoivent
les traces d'hydrocarbures laissées sur le sol par des Lasius niger,
ce qui n'est pas le cas des sédentaires (Mestre et al 2020).
Hydrocarbures
et parabiose
Une espèce de Crematogaster
fréquente les pistes de Camponotus en forêt tropicale
de Guyane dans les jardins de fourmis. Les Crematogaster émettent
une substance apaisante (crematoenone) envers les Camponotus, mais
il persiste une reconnaissance spécifique par les hydrocarbures (Menzel
et al. 2013). En fait il y a deux espèces cryptiques Crematogaster
levior A et B, Camponotus femoratus PAT et PS qui se différencient
génétiquement et selon les hydrocarbures. La vie en parabiose
s'accompagne d'hydrocarbures plus lourds, par comparaison aux espèces
non-parabiotiques. On ne sait pas si cela rentre dans du camouflage chimique
ou du mimétisme chimique (Sprenger et al 2019, Hartke et al 2019).
Hydrocarbures
et phénomème du "cher ennemi"
Chez Ectatomma
brunneum au Brésil il y moins d'agressivité intercoloniale
entre colonies voisines (étude jusqu'à 3km) et cela semble lié
aux différences de profils d'hydrocarbures. Cela a déjà
été vu pour de nombreuses espèces (Periera et al 2019).
Métabolisme
des hydrocarbures
Ils sont synthétisés
dans les œnocytes du corps gras. Ils sont ensuite transportés dans
l'hémolymphe par la lipophorine et stockés dans la glande postpharyngienne
(PPG) puis excrétés sur la cuticule (voir par exemple Lucas et
al 2004).
Rôle
des bactéries
Un traitement antibiotique induit un état de stress qui se traduit par
une augmentation d'hydrocarbures cuticulaires chez Aphaenogaster senilis,
mais pas chez A. iberica qui n'a sans doute pas les mêmes
bactéries symbiotiques (Lenoir et Devers 2018).
Chez les Camponotus il y a de nombreuses bactéries symbiotiques
qui jouent sur la production des hydrocarbures. Un traitement antibiotique induit
la production de plus d’hydrocarbures cuticulaires et une cuticule plus
mélanisée, mais le profil ne semble pas changé (de Souza
et al 2011).
Le microbiome sert aussi à élaborer les hydrocarbures cuticulaires,
et donc à l'identité coloniale.
Chez l'abeille, chaque colonie possède un microbiome spécifique
qui influe sur les hydrocarbures. Pour le moment on ne sait pas comment cela
se réalise, peut-être en modifiant l’expression des enzymes
utilisées dans la synthèse des hydrocarbures, ou en fournissant
différents composés aux œnocytes (Vernier et al 2020, voir
Rohrbacher 2020).
Les pucerons ont des endosymbiontes qui affectent la qualité de leur miellat et de leurs hydrocarbures. Les auteurs ont étudié chez le pucerons Aphis fabae deux espèces de bactéries endosymbiontes (Hamiltonella et Regiella). Ceux-ci modifient le profil d'HCs de leur hôte et cela permet aux fourmis Lasius niger de les différencier. On savait déjà que les L. niger sont capables de reconnaître les pucerons à leur profil d'HCs mais pas que celui-ci est influencé par les bactéries symbiontes (Hertaeg et al 2021).
Nanoparticules. Une publication très importante sur des Formica de Roumanie montre les effets toxiques du dioxyde de titane (TiO2). F. polyctena et F. pratensis sont territoriales et très agressives et marquent les limites de leur colonie. Sous l'influence du TiO2 l'agressivité change et cela est lié aux modifications du profil cuticulaire d'hydrocarbures qui sont oxydés en alcools, aldéhydes et acides carboxyliques (Czekes et al 2022).
Voir
- Coulon, A.
(2019) Le mécanisme de répartitions des tâches des fourmis
découvert à l'UNIL. 6 mars 2019.
Vidéo
de 2 min sur le site de rts.ch. Pdf
- Dahbi, A., X. Cerdá and A. Lenoir (1998). Ontogeny of colonial
hydrocarbon label in callow workers of the ant Cataglyphis iberica. Compte Rendus
Académie des Sciences Paris 321: 395-402. Pdf
- de Souza, D. J., S. Devers and A. Lenoir (2011). Blochmannia endosymbionts
and their host, the ant Camponotus
fellah: Cuticular hydrocarbons and melanization. Comptes Rendus Biologie
334: 737-741. Pdf
- d'Ettorre, P. and A. Lenoir
(2010). Nestmate recognition in ants. Ant Ecology. L. Lach, C. Parr and K. Abbott.
Oxford, Oxford University Press: 194-209. Pdf
- Dupraz,
M., C. Leroy, T. L. Thórarinsson, P. D'Ettorre and K. D. McCoy (2022).
Within and among population differences in cuticular hydrocarbons in the seabird
tick Ixodes uriae. Peer Community Journal 2. doi: 10.24072/pcjournal.16
-
Ichinose, K., and Lenoir, A. (2009). Ontogeny of hydrocarbon profiles in the
ant Aphaenogaster senilis and effects of social isolation. C.R. Biologies 332,
697-703. Pdf
- Lenoir, A. (1979). Le comportement alimentaire et la division du travail chez
la fourmi Lasius niger. Bulletin Biologique de la France et de la Belgique 113:
79-314. Pdf
- Lenoir A., Depickère S., Devers S., Christidès J.-P., Detrain
C. (2009) – Hydrocarbons in the ant Lasius niger: from cuticle to the
nest and home range marking. Journal of Chemical Ecology, 35, 913-921. Doi :
10.1007/s10886-009-9669-6. Pdf
- Lenoir, A. and S. Devers (2018). Alkaloid secretion inhibited by antibiotics
in Aphaenogaster ants. Comptes Rendus Biologies 341: 358-361. https://doi.org/10.1016/j.crvi.2018.06.004
Pdf
-
Meurisse, M. (2019). L'hormone qui durcit la carapace des fourmis. Le Monde
Sciences & Médecine 13 mars 2019. Pdf
- Miner, M. C. and E.
E. Wilson Rankin (2023). Bumble Bee Avoidance of Argentine Ants and Associated
Chemical Cues. Journal of Insect Behavior. 10.1007/s10905-023-09815-w. Pdf
- Rohrbacher, F. (2020).
Les abeilles domestiques s'identifient grâce à leur microbiome.
Le Monde Science et Médecine. 28 octobre 2020. Pdf
(voir texte)
- Akino, T. and R. Yamaoka (2002). Cuticular hydrocarbon profile as a critical
cue candidate for nestmate recognition in Lasius
fuliginosus (Hymenoptera:
Formicidae). Entomological Science 5: 267-273.
- Antonialli, W. F., Jr., S. M. Lima, L. H. C. Andrade and Y. R. Suarez (2008a).
Comparative study of the cuticular hydrocarbon in queens, workers and males
of Ectatomma vizottoi (Hymenoptera, Formicidae) by Fourier transformation-infrared
photoacoustic spectroscopy. Genet Mol Res 6: 492-499.
- Antonialli, W. F., Jr., Y. R. Suarez, T. Izida, L. H. C. Andrade and S. M.
Lima (2008b). Intra- and interspecific variation of cuticular hydrocarbon composition
in two Ectatomma species (Hymenoptera: Formicidae) based on Fourier transform
infrared photoacoustic spectroscopy. Genet Mol Res 7(2): 559-566.
- Bagnères, A.-G. and E. D. Morgan (1990). A simple method for analysis
of insect cuticular hydrocarbons. Journal of Chemical Ecology 16: 3263-3276.
-
Balbuena, M., A. González Ritzel and W. Farina (2017). Characterization
of cuticular hydrocarbons according to colony duties in the stingless bee Tetragonisca
angustula. Apidologie 49: 1-11. doi: 10.1007/s13592-017-0539-x
- Barbero, F. (2016). Cuticular Lipids as a Cross-Talk among Ants, Plants and
Butterflies. International Journal of Molecular Sciences 17(12). 10.3390/ijms17121966
- Bastin,
F., F. Savarit, G. Lafon and J.-C. Sandoz (2017). Age-specific olfactory attraction
between Western honey bee drones (Apis mellifera) and its chemical basis. PLOS
ONE 12: e0185949. 10.1371/journal.pone.0185949
- Bonavita-Cougourdan
A, Clément J-L, Lange C (1987) Nestmate recognition: the role of cuticular
hydrocarbons in the ant Camponotus vagus Scop. J Entomol Sci 22:1-10
- Bonavita-Cougourdan,
A., J.-L. Clément and C. Lange (1993). Functional subcaste discrimination
(foragers and brood-tenders) in the ant Camponotus vagus Scop.: polymorphism
of cuticular hydrocarbon patterns. Journal of Chemical Ecology 19: 1461-1477.
-
Caliari Oliveira, R., J. van Zweden and T. Wenseleers (2022). Similarities in
Recognition Cues Lead to the Infiltration of Non-Nestmates in an Ant Species.
Journal of Chemical Ecology 48(1): 16-26. doi: 10.1007/s10886-021-01325-3.
- Cordonnier, M., T. Gayet, G. Escarguel and B. Kaufmann (2019). From hybridization
to introgression between two closely related sympatric ant species. Journal
of Zoological Systematics and Evolutionary Research 57(4): 778-788. doi: 10.1111/jzs.12297.
-
Csata, E., L. P. Casacci, J. Ruther, A. Bernadou, J. Heinze and B. Markó
(2022). What does not kill you makes you peaceful: non-lethal fungal infection
could reduce aggression towards strangers in ants. Preprint.
- Czekes, Z., D. Bai, J. Vincze, G. Emese, Z. Nagy, L. Baia and Z. Pap (2022).
Commercial photocatalyst changes the behavior of Formica pratensis and Formica
polyctena. Environmental Science: Nano. doi: 10.1039/d1en01119g.
- Dailygeekshow (2018) Ces fourmis terrifiantes décapitent leurs victimes
afin de collectionner leurs têtes. Dailygeekshow.com, 21 novembre 2018,
p. https://dailygeekshow.com/fourmi-formica-archboldi-crane-proie-collection/
Avec vidéo
- Errard, C. (1994). Development of interspecific recognition behavior in
the ants Manica rubida and Formica selysi (Hymenoptera: Formicidae) reared in
mixed-species groups. Journal of Insect Behavior 7(1): 83-99.
- Gadi,
R., Shivani, S. K. Sharma and T. K. Mandal (2019). Source apportionment and
health risk assessment of organic constituents in fine ambient aerosols (PM2.5):
A complete year study over National Capital Region of India. Chemosphere 221:
583-596. https://doi.org/10.1016/j.chemosphere.2019.01.067
- Grasso, D. A., M. F. Sledge, F. Le Moli, A. Mori and S. Turillazzi (2005).
Nest-area marking with faeces: a chemical signature that allows colony-level
recognition in seed-harvesting ants (Hymenoptera, Formicidae). Insectes Sociaux
52: 36-44.
- Hartke, J., P. P. Sprenger, J. Sahm, H. Winterberg, J. Orivel, H. Baur,
T. Beuerle, T. Schmitt, B. Feldmeyer and F. Menzel (2019). Cuticular hydrocarbons
as potential mediators of cryptic species divergence in a mutualistic ant association.
Ecology and Evolution 9(16): 9160-9176. 10.1002/ece3.5464
-
Haouzi, M., J. Gévar, A. Kahlil and E. Darrouzet (2021). Nest structures
display specific hydrocarbon profiles: insights into the chemical ecology of
the invasive yellow-legged hornet Vespa velutina nigrithorax. Chemoecology.
doi: 10.1007/s00049-021-00343-7.
-
Hertaeg,
C., M. Risse, C. Vorburger, C. De Moraes and M. C. Mescher (2021). Aphids harbouring
different endosymbionts exhibit differences in cuticular hydrocarbon profiles
that can be recognized by ant mutualists. Scientific Reports 11. doi: 10.1038/s41598-021-98098
- Holze, H., L. Schrader and J. Buellesbach (2021). Advances in deciphering
the genetic basis of insect cuticular hydrocarbon biosynthesis and variation.
Heredity 126(2): 219-234. doi: 10.1038/s41437-020-00380-y.
- Jonhson,
D. (2019). Du carburant venu des microbes. Courrier International 1496, 4-10
juillet 2019: p. 46.
- Kaib, M., B. Eisermann, E. Schoeters, J. Billen, S. Francke and W. Francke
(2000). Task related variation of postpharyngeal and cuticular hydrocarbon compositions
in the ant Myrmicaria eumenoides. J. Comp. Physiol. A 186: 939-948.
- Kather, R., F. Drijfhout and S. Martin (2011). Task Group Differences in Cuticular
Lipids in the Honey Bee Apis mellifera. Journal of Chemical Ecology 37(2): 205-212.
- Koto, A., N. Motoyama, H. Tahara, S. McGregor, M. Moriyama, T. Okabe,
M. Miura and L. Keller (2019). Oxytocin/vasopressin-like peptide inotocin regulates
cuticular hydrocarbon synthesis and water balancing in ants. Proceedings of
the National Academy of Sciences: 201817788. 10.1073/pnas.1817788116
- Lemoine, M., T. Engl and M. Kaltenpoth (2020). Microbial symbionts expanding
or constraining abiotic niche space in insects. Current Opinion in Insect Science.
10.1016/j.cois.2020.01.003
- Lucas, C., D. B. Pho, D. Fresneau and J. M. Jallon (2004). Hydrocarbon circulation
and colonial signature in Pachycondyla villosa. J. Ins. Physiol. 50: 595-607.
- Martin, S. J. and F.
P. Drijfhout (2009). Nestmate and task cues are influenced and encoded differently
within ant cuticular hydrocarbon profiles. Journal of Chemical Ecology: DOI
10.1007/s10886-10009-19612-x.
- Menzel, F., B. B. Blaimer and T. Schmitt (2017). How do cuticular hydrocarbons
evolve? Physiological constraints and climatic and biotic selection pressures
act on a complex functional trait. Proceedings of the Royal Society B: Biological
Sciences 284(1850). doi: 10.1098/rspb.2016.1727.
-
Menzel, F., M. Zumbusch and B. Feldmeyer (2018). How ants acclimate: impact
of climatic conditions on the cuticular hydrocarbon profile. Funct Ecol 32:
657-666
-
Menzel, F., S. Morsbach, J. H. Martens, P. Räder, S. Hadjaje, M. Poizat
and B. Abou (2019). Communication versus waterproofing: the physics of insect
cuticular hydrocarbons. The Journal of Experimental Biology 222(23): jeb210807.
10.1242/jeb.210807
- Mestre, L., N. Narimanov,
F. Menzel and M. H. Entling (2020). Non-consumptive effects between predators
depend on the foraging mode of intraguild prey. Journal of Animal Ecology, in
press. doi: 10.1111/1365-2656.13224.
- Moris,
V. C., K. Christmann, A. Wirtgen, S. A. Belokobylskij, A. Berg, W.-H. Liebig,
V. Soon, H. Baur, T. Schmitt and O. Niehuis (2021). Cuticular hydrocarbons on
old museum specimens of the spiny mason wasp, Odynerus spinipes (Hymenoptera:
Vespidae: Eumeninae), shed light on the distribution and on regional frequencies
of distinct chemotypes. Chemoecology. doi: 10.1007/s00049-021-00350-8
- Pereira, M. C., E.
L. Barbosa Firmino, R. C. Bernardi, L. D. Lima, I. de Carvalho Guimarães,
C. A. Lima Cardoso and A. J. William Fernnando (2019). Dear Enemy Phenomenon
in the Ant Ectatomma brunneum (Formicidae: Ectatomminae): Chemical Signals Mediate
Intraspecific Agressive Interactions. Sociobiology 66: 218-226. DOI: 10.13102/sociobiology.v66i2.3554
- Pulliainen,
U., N. Bos, P. d’Ettorre and L. Sundström (2021). The Scent of Ant
Brood: Caste Differences in Surface Hydrocarbons of Formica
exsecta Pupae. Journal of Chemical Ecology. doi: 10.1007/s10886-021-01275-w
- Ruhland,
F., G. Gabant, T. Toussaint, M. Nemcic, M. Cadène and C. Lucas (2023).
Reproductives signature revealed by protein profiling and behavioral bioassays
in termite. Scientific Reports 13(1): 7070. 10.1038/s41598-023-33252-
- Santos Junior, L. C.,
K. B. Michelutti, R. C. Bernardi, E. P. Silva, C. A. L. Cardoso and W. F. Antonialli
- Junior (2022). You smell different! Temperature interferes with intracolonial
recognition in Odontomachus brunneus. Sociobiology 69(1): e6235. doi: 10.13102/sociobiology.v69i1.6235.
- Sharma, Kavita R.,
Brittany L. Enzmann, Y. Schmidt, D. Moore, Graeme R. Jones, J. Parker, Shelley
L. Berger, D. Reinberg, Laurence J. Zwiebel, B. Breit, et al. (2015). Cuticular
Hydrocarbon Pheromones for Social Behavior and Their Coding in the Ant Antenna.
Cell Reports 12: 1261-1271. 10.1016/j.celrep.2015.07.031
-
Scholl, J. and D. Naug (2011). Olfactory discrimination of age-specific hydrocarbons
generates behavioral segregation in a honeybee colony. Behavioral Ecology and
Sociobiology, Springer Berlin / Heidelberg: 1-7.
- Shivani, R. Gadi, S. K. Sharma, T. K. Mandal, R. Kumar, S. Mona, S. Kumar
and S. Kumar (2018). Levels and sources of organic compounds in fine ambient
aerosols over National Capital Region of India. Environmental Science and Pollution
Research. 10.1007/s11356-018-3044-5
- Smith, A. A. (2018). Prey specialization and chemical mimicry between Formica
archboldi and Odontomachus ants. Insectes Sociaux in press. doi.org/10.1007/s00040-018-0675-y
- Solé, E. (2020) Les abeilles détecteraient leurs congénères
décédées à leur absence d'odeur. Futura
Science, 23 mars 2020, https://www.futura-sciences.com/planete/breves/abeille-abeilles-detecteraient-leurs-congeneres-decedees-leur-absence-odeur-2217/
- Sprenger,
P., J. Hartke, B. Feldmeyer, T. Schmitt and F. Menzel (2019). Influence of Mutualistic
Lifestyle, Mutualistic Partner, and Climate on Cuticular Hydrocarbon Profiles
in Parabiotic Ants. Journal of Chemical Ecology. 10.1007/s10886-019-01099-9
-
Sprenger, P. and F. Menzel (2020). Cuticular hydrocarbons in ants (Hymenoptera:
Formicidae) and other insects: how and why they differ among individuals, colonies,
and species. Myrmecological News 30: 1-26. 10.25849/myrmecol.news_030:001
- Sprenger,
P. P., L. J. Gerbes, J. Sahm and F. Menzel (2021). Cuticular hydrocarbon profiles
differ between ant body parts: implications for communication and our understanding
of CHC diffusion. Current Zoology zoab012. doi: https://doi.org/10.1093/cz/zoab012
- Vernier,
C., J. Krupp, K. Marcus, A. Hefetz, J. Levine and Y. Ben-Shahar (2019). The
cuticular hydrocarbon profiles of honey bee workers develop via a socially-modulated
innate process. eLife 8. doi: 10.7554/eLife.41855.
- Vernier, C. L., I.
M. Chin, B. Adu-Oppong, J. J. Krupp, J. Levine, G. Dantas and Y. Ben-Shahar
(2020). The gut microbiome defines social group membership in honey bee colonies.
Science Advances 6(42): eabd3431. doi: 10.1126/sciadv.abd3431.
-
Wagner, D., M. J. F. Brown, P. Broun, W. Cuevas, L. E. Moses, D. L. Chao and
D. M. Gordon (1998). Task-related differences in the cuticular hydrocarbon composition
of harvester ants, Pogonomyrmex barbatus. J. Chem. Ecol. 24: 2021-2037.
- Walsh,
J., L. Pontieri, P. d'Ettorre and T. Linksvayer (2019). Ant cuticular hydrocarbons
are heritable and associated with variation in colony productivity. bioRxiv.
http://dx.doi.org/10.1101/819870. Libre
de droits
- Wen,
P. (2020). Drop of life associated cuticular hydrocarbon emission triggers undertaking
in Apis cerana. bioRxiv 2020.03.05.978262. https://doi.org/10.1101/2020.03.05.978262
-
Wittke, M., L. Baumgart and F. Menzel (2022). Acclimation in ants: Interference
of communication and waterproofing through cuticular hydrocarbons in a multifunctional
trait. Functional Ecology 00: 1-13. doi: https://doi.org/10.1111/1365-2435.14104